Salle blanche pour la médecine régénératrice (biotechnologie)
Mecart s’est associé au NJIT pour concevoir et installer des salles blanches de haute qualité (Grade B et C), conformes aux normes des bonnes pratiques de fabrication (BPF, en anglais Good Manufacturing Practices ou GMP) pour développer la médecine de demain, la médecine régénératrice.
L’espace de laboratoire de salles blanches GMP comprend des sas pour le personnel, des sas pour le matériel, des passe-plats personnalisés et une unité de traitement d’air séparée (AHU) pour éviter la contamination croisée entre les suites.
Ce projet de salle blanche s’étend sur près de 2 000 pieds carrés. Le calendrier serré du projet a constitué un défi, mais le produit final est entièrement installé et contribue au développement de thérapies cellulaires et géniques.
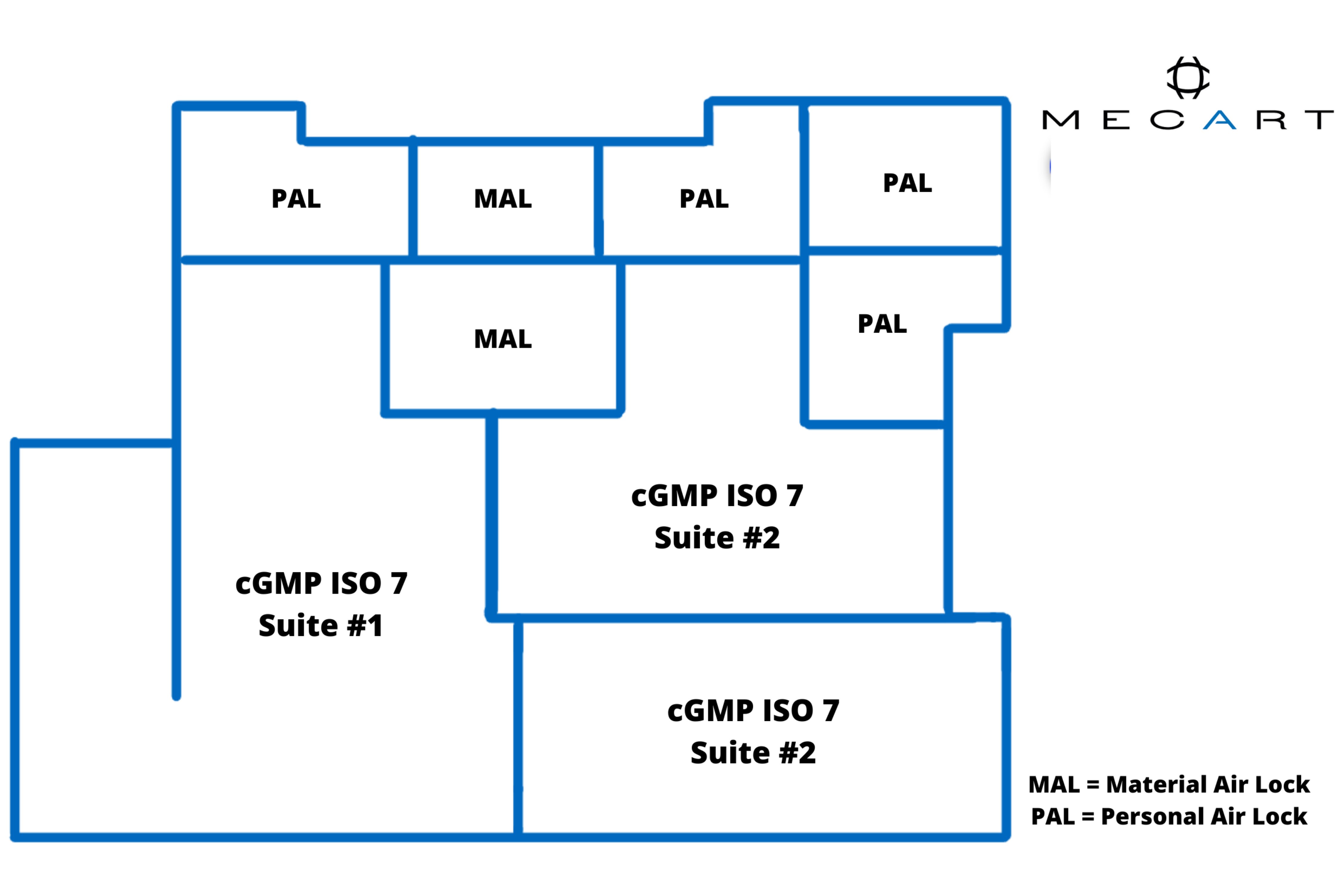
Ces salles blanches contiennent également :
- Une salle blanche BSL 2 entièrement équipée
- 2 suites cGmp (BPF) pour la production clinique de thérapie cellulaire et génique (ISO7)
- Fabrication de vecteurs viraux (thérapie génique)
- Thérapies cellulaires pour le CAR-T
Téléchargez notre brochure
Des laboratoires GMP pour la R&D et la production de biothérapies
Le New Jersey Institute of Technology / BioCentriq a lancé un programme de maîtrise et un certificat d’études supérieures en thérapie cellulaire et génique pour répondre à l’intérêt et la croissance rapide dans ce domaine.
« Il y a une forte demande pour une main-d’œuvre qualifiée dans l’industrie de la thérapie cellulaire et génique, particulièrement dans le New Jersey, qui devient une plaque tournante dans le développement des nouvelles thérapies, » rapporte Haro Hartounian, directeur général de l’innovation de la biotechnologie et pharmaceutique au NJIT.
La salle blanche fournit également un environnement pour les jeunes entreprises dans le monde de la biotechnologie pour développer leurs entreprises et leurs produits, grâce au programme d’incubation pour les startups du NJIT.
De plus, grâce à une demande accrue de Contract Development and Manufacturing Organizations (CDMO) pour la thérapie cellulaire et génique, les salles blanches seront disponibles à la location pour les entreprises de biotech.
À propos de la thérapie cellulaire et génique
La FDA a donné son feu vert au premier traitement de thérapie génique en 2017, créant ainsi un secteur de médecine novatrice en pleine expansion qui devrait transformer la médecine grâce au traitement d’une multitude de maladies qui sont, jusqu’à présent, incurables.
Les thérapies cellulaires et géniques ont été mises au point pendant des décennies et devraient maintenant s’attaquer à un grand nombre de maladies chroniques et rares dans le monde.
L’Agence fédérale américaine des produits alimentaires et médicamenteux (FDA) prévoit d’approuver jusqu’à 20 produits de thérapie génique par an d’ici 2025, compte tenu du nombre croissant de produits de thérapie cellulaire et génique en cours de développement et d’essais cliniques.
En 2020, plus de 360 nouvelles thérapies cellulaires et géniques se trouvent à des stades précoces ou avancés de développement clinique.




